ΠΕΡΙΣΤΑΤΙΚΟ ΚΑΡΔΙΟ-ΟΓΚΟΛΟΓΙΑΣ
Πέγκυ Κωστάκου-Μαρία Καλαντζή
Ασθενής γυναίκα 55 ετών προσήλθε στο Τμήμα Επειγόντων του Γενικoύ Νοσοκομείου Ελευσίνας Θριάσιο, λόγω δύσπνοιας από μηνών με επιδείνωση το τελευταίο 24ώρο. Στο ηλεκτροκαρδιογράφημα διαπιστώθηκε φλεβοκομβικός ρυθμός.
Η ασθενής αναφέρει ελεύθερο καρδιολογικό ιστορικό. Προ 7μήνου διαγνώσθηκε με μεταστατικό Ca μαστού που αντιμετωπίστηκε με μαστεκτομή αριστερά, ακτινοβολία στην περιοχή του αριστερού ημιθωρακίου (συνολική δόση 20 Gy) και στη συνέχεια (υποβάλλεται από τότε σε) χημειοθεραπεία (7 κύκλοι Trastuzumab + Pertuzumab) χωρίς (να έχει καμία) καρδιολογική παρακολούθηση.
Στην κλινική εξέταση διαπιστώθηκαν οιδήματα κάτω άκρων και τρίζοντες άμφω κατά την ακρόαση των πνευμόνων. Η ακτινογραφία θώρακα ανέδειξε γραμμές Kerley B και υπεζωκοτική συλλογή άμφω. Από τον εργαστηριακό έλεγχο παθολογικές ήταν οι τιμές των Hs-HTN: 32 μg/L και NTpro-BNP: 2750 pg/mL. Η ασθενής εισήχθη στην Καρδιολογική κλινική και υποβλήθηκε σε πλήρη υπερχοκαρδιογραφική μελέτη όπου διαπιστώθηκαν αριστερή κοιλία (AK) αυξημένων εσωτερικών διαστάσεων (3,4cm/m2) με φυσιολογικό πάχος τοιχωμάτων, σοβαρή διάχυτη υποκινησία τοιχωμάτων και σοβαρά επηρεασμένη συνολική συστολική λειτουργικότητα [κλάσμα εξώθησης (EF): 20% (Video:1),συνολικό επίμηκες strain (GLS): -6.8% (Εικόνα 1).
Video 1
Εικόνα 1
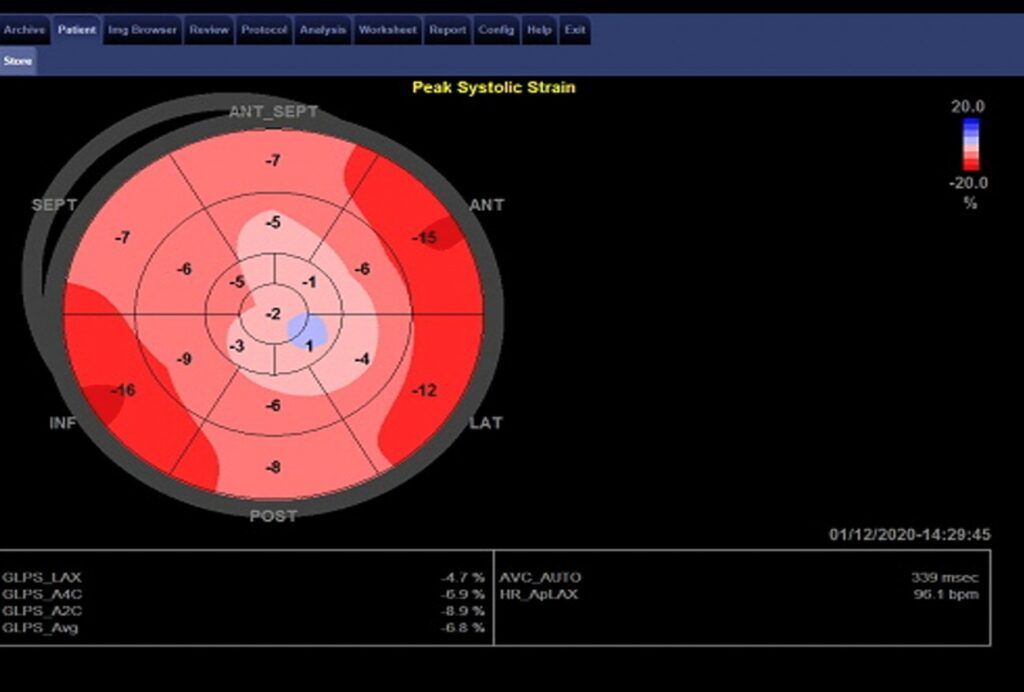
Δεξιά κοιλία (ΔΚ) οριακών διαστάσεων με επηρεασμένη λειτουργικότητα (FAC=30%), αμφικολπική διάταση με μέτρια λειτουργική ανεπάρκεια μιτροειδούς βαλβίδας (Video 2) και σοβαρή πνευμονική υπέρταση (Video 3).
και σοβαρή πνευμονική υπέρταση (Video 3).
Η ασθενής ετέθη σε πλήρη αγωγή καρδιακής ανεπάρκειας με sacubitril/valsartan, carvedilol, eplerenone, rosuvastatin και υψηλές δόσεις furosemide. Στη συνέχεια υποβλήθηκε σε αξονική θώρακος που ανέδειξε πνευμονική εμβολή σε περιφερικούς κλάδους και στην αγωγή της ασθενούς προστέθηκε fondaparinux. Κατά τη διάρκεια 2 εβδομάδων νοσηλείας έγινε τιτλοποίηση της θεραπείας της καρδιακής ανεπάρκειας στα μέγιστα ανεκτά επίπεδα και η ασθενής εξήλθε με οδηγίες για τακτή καρδιολογική παρακολούθηση ανά μήνα. Μετά από επικοινωνία με το θεράποντα ογκολόγο η χημειοθεραπευτική αγωγή διακόπηκε πριν πραγματοποιηθεί ο τελευταίος κύκλος.
Στην τελευταία επίσκεψη, η υπερηχοκαρδιογραφική μελέτη (5 μήνες μετά τη διακοπή του trastuzumab) ανέδειξε ΑΚ αυξημένων διαστάσεων (3,3cm/m2) με διατηρημένη συνολική συστολική λειτουργικότητα (EF:50%) (Video 4), [3 διαστάσεων EF:49.85% (Video 5)
Video 4
Video 5
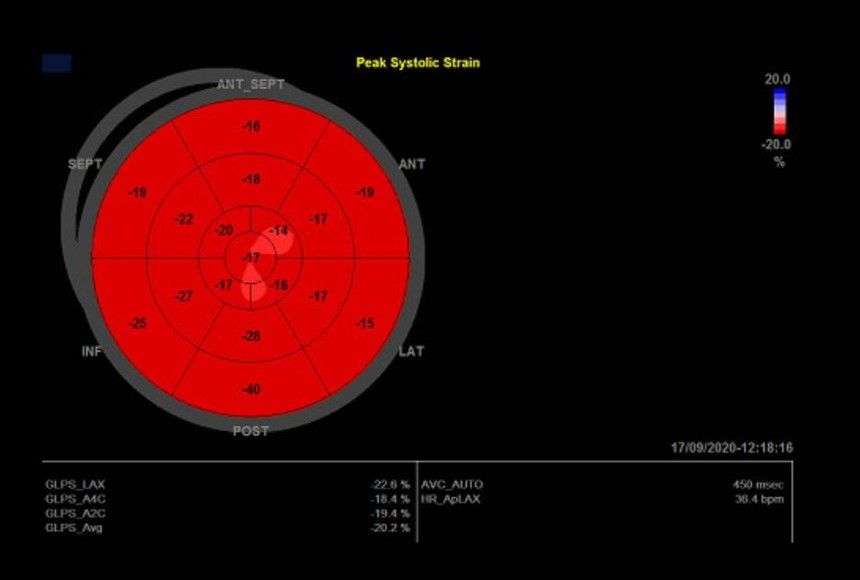
και GLS:-20.2% (Εικόνα 2)],
ΔΚ φυσιολογικών διαστάσεων με καλή λειτουργικότητα, φυσιολογικών διαστάσεων αριστερός και δεξιός κόλπος και μικρή ανεπάρκεια μιτροειδούς και τριγλώχινας βαλβίδας (Video 6).
Η ασθενής υποβλήθηκε στη συνέχεια και σε Μαγνητική Τομογραφία Καρδιάς (ΜΤΚ) η οποία πραγματοποιήθηκε σε μαγνήτη 1.5 T (Avanto, Siemens,
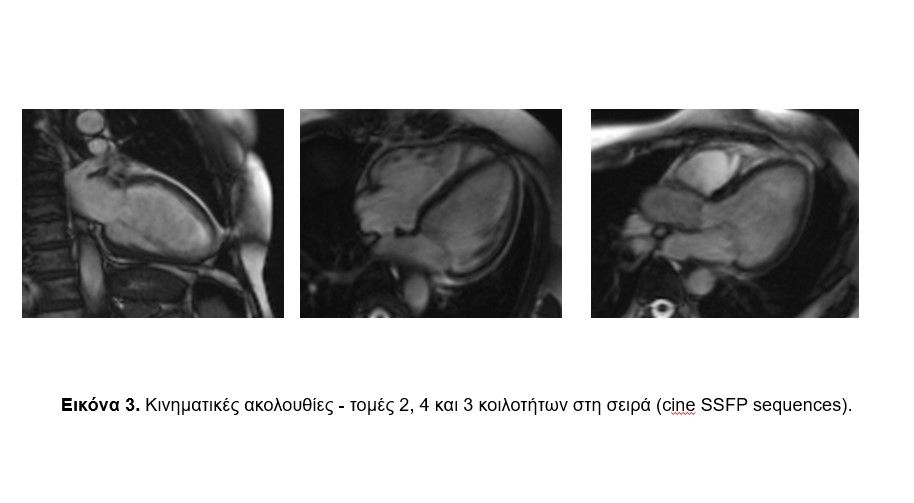
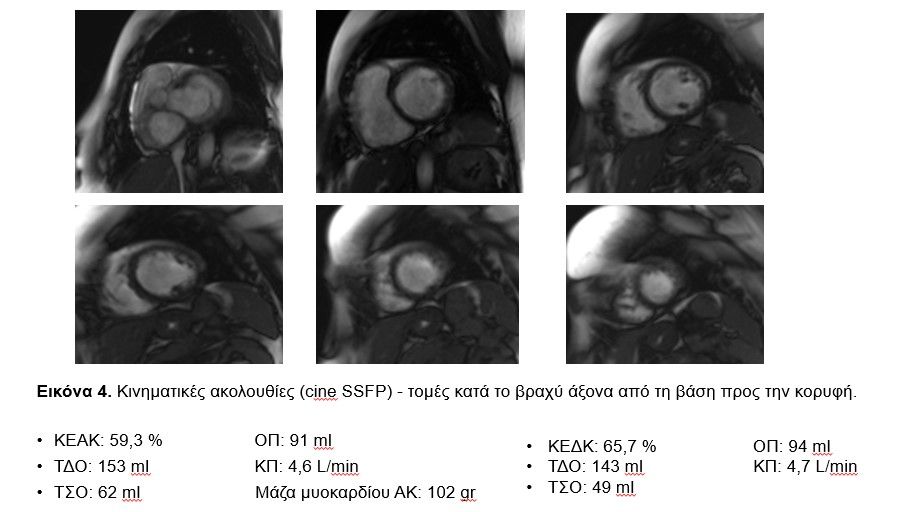
Erlangen, Germany) με στόχους τον ακριβή προσδιορισμό του ΚΕΑΚ και το χαρακτηρισμό του μυοκαρδίου. Η λειτουργικότητα της ΑΚ και της ΔΚ μελετήθηκαν με κινηματικές ακολουθίες (2,3 και 4 κοιλότητες και κατά το βραχύ άξονα – cine SSFP: Steady-State Free Precession sequences, Eικόνες 3 και 4). Η ανάλυση κατέδειξε φυσιολογικές παραμέτρους τόσο για την ΑΚ όσο και τη ΔΚ χωρίς τμηματικές υποκινησίες τοιχωμάτων (Eικόνα 4).
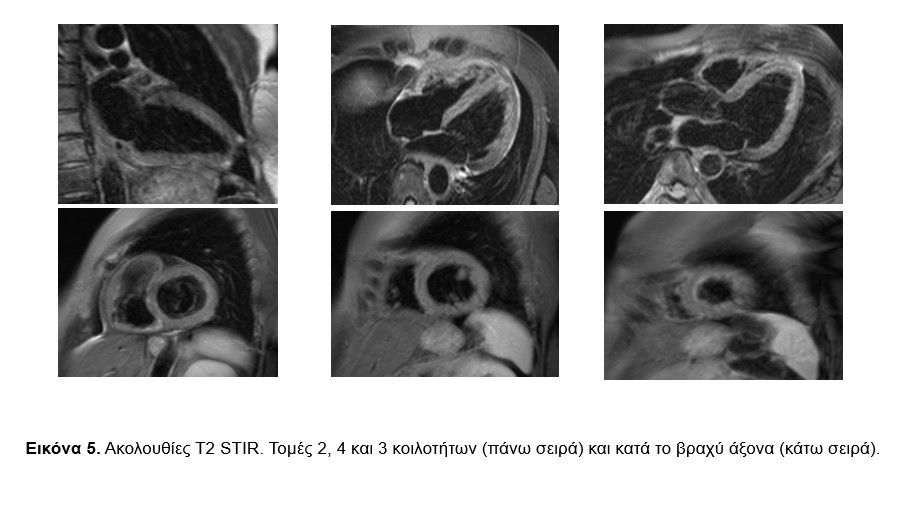
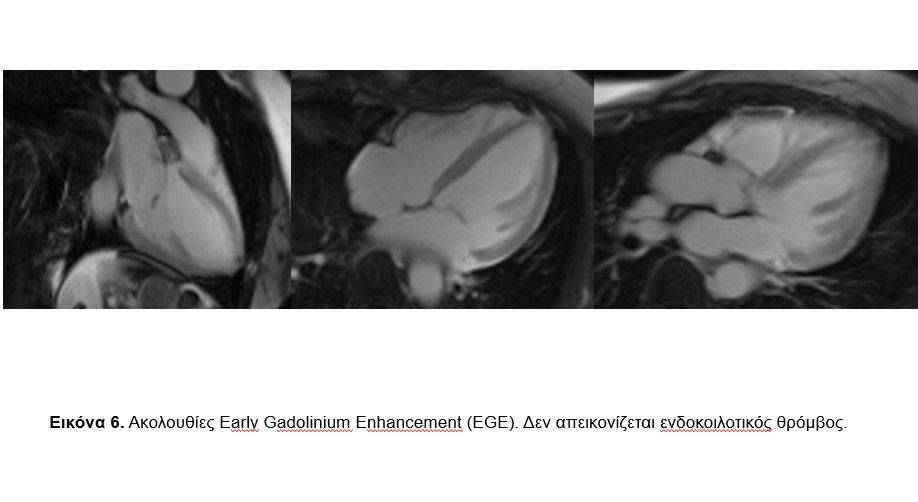
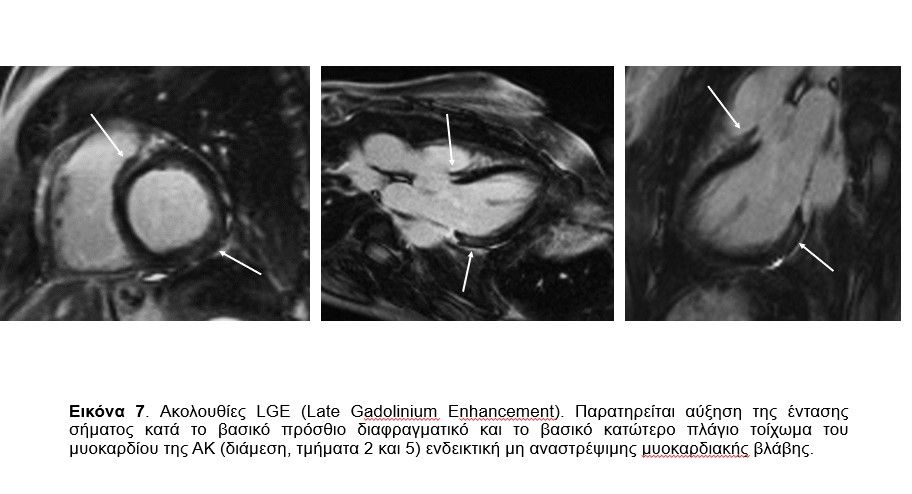
Στις ακολουθίες T2 STIR (για την ταυτοποίηση πιθανού οιδήματος/ φλεγμονής) δεν φάνηκε αύξηση της έντασης σήματος με ποιοτική ανάλυση (Eικόνα 5). Στις ακολουθίες που ελήφθησαν νωρίς μετά την ενδοφλέβια χορήγηση του γαδολινίου (Gd) (Early Gadolinium Enhancement, EGE, 2-5 min) δεν φάνηκε η ύπαρξη ενδοκοιλοτικού θρόμβου (Eικόνα 6). Στις ακολουθίες LGE (Late Gadolinium Enhancement, 8-20 min μετά την ενδοφλέβια χορήγηση του Gd), που αποτελεί τον ακρογωνιαίο λίθο για τον χαρακτηρισμό των ιστών, φάνηκε αύξηση της έντασης σήματος κατά το βασικό πρόσθιο διαφραγματικό και το βασικό κατώτερο πλάγιο τοίχωμα του μυοκαρδίου της ΑΚ (διάμεση, τμήματα 2 και 5) ενδεικτική μη αναστρέψιμης μυοκαρδιακής βλάβης (Εικόνα 7).
Οι υποδοχείς HER2 (trastuzumab, pertuzumab) εκφράζονται στα μυοκαρδιακά κύτταρα όπου εμπλέκονται σε ενδοκυττάρια μονοπάτια που ελέγχουν τη διαδικασία της απόπτωσης, της κυτταρικής αναγέννησης και σε κάποιο βαθμό της συστολικής λειτουργίας [1]. Αναστέλλοντας τους υποδοχείς HER2 το trastuzumab μπορεί να οδηγήσει σε δυσλειτουργία της ΑΚ [2], αλλά ο ακριβής μηχανισμός της καρδιοτοξικότητας που αναπτύσσεται δεν είναι πλήρως
κατανοητός έως σήμερα. Σε μία μελέτη 45.000 ασθενών [3] που έλαβαν θεραπεία για καρκίνο μαστού, η επίπτωση νεοδιαγνωσθείσας καρδιακής ανεπάρκειας ή δυσλειτουργίας της ΑΚ ήταν 31% γι΄αυτούς που έλαβαν trastuzumab μεμονωμένα, 42% για όσους έλαβαν trastuzumab σε συνδυασμό με ανθρακυκλίνες ενώ η προσθήκη pertuzumab δε φάνηκε να αυξάνει την εμφάνιση καρδιοτοξικότητας [4].
Η ακτινοβόληση της περιοχής του θώρακα ενοχοποιείται κυρίως για την εμφάνιση στεφανιαίας νόσου, βαλβιδοπαθειών, μυοκαρδίτιδας ή/και περικαρδίτιδας και πιο σπάνια περιοριστικής μυοκαρδιοπάθειας ή συμπιεστικής περικαρδίτιδας [5].
Η προκαλούμενη από το trastuzumab δυσλειτουργία της ΑΚ είναι σε κάποιο βαθμό αναστρέψιμη όταν η χορήγησή του διακοπεί. Δεν υπάρχουν όμως δεδομένα για αν και για πόσο θα πρέπει να συνεχίζεται η χορήγηση θεραπείας καρδιακής ανεπάρκειας σε αυτούς τους ασθενείς που αποκαθιστούν την καρδιακή λειτουργία και έχουν ολοκληρώσει και τη θεραπεία για τον καρκίνο.
Στο συγκεκριμένο περιστατικό η απάντηση στο παραπάνω ερώτημα δίνεται από την ΜΤΚ που ταυτοποιεί την ύπαρξη ίνωσης στην ΑΚ παρόλη την αποκατάσταση της λειτουργικότητας της καρδιάς. Η ασθενής θα πρέπει να συνεχίσει μόνιμα την αγωγή της καρδιακής ανεπάρκειας και σίγουρα, αν μελλοντικά χρειαστεί να υποβληθεί ξανά σε χημειοθεραπείες, σε συνεργασία με τον ογκολόγο, θα πρέπει να παρακολουθείται σε τακτική καρδιολογική βάση και να αποφύγει τη λήψη καρδιοτοξικών παραγόντων.
Επομένως, ο ρόλος της απεικόνισης στην Καρδιο-ογκολογία είναι κρίσιμος για τη διάγνωση, την παρακολούθηση αλλά και την μακροχρόνια πρόγνωση των ασθενών που υποβάλλονται σε χημειοθεραπεία. Αυτό άλλωστε υπογραμμίζεται από την Ευρωπαϊκή Εταιρεία Ιατρικής Ογκολογίας [6] καθώς και την Ευρωπαϊκή Καρδιολογική Εταιρεία όπου σε πρόσφατο “position paper” προτείνονται πλέον συγκεκριμένα υπερηχοκαρδιογραφικά πρωτόκολλα παρακολούθησης ανάλογα με το χημειοθεραπευτικό παράγοντα που χρησιμοποιείται για τον κάθε ασθενή προκειμένου να διαγνωσθεί και να αντιμετωπιστεί εγκαίρως η καρδιοτοξικότητα [7]. Επιπρόσθετα, η ΜΤΚ αποτελεί μία αναίμακτη, χωρίς ακτινοβολία, χρήσιμη απεικονιστική μέθοδο για την εκτίμηση της καρδιοτοξικότητας που προκαλείται από τις αντικαρκινικές θεραπείες [8-9]. Ο συνδυασμός από πολλές και διαφορετικές τεχνικές δίνει πληροφορίες για την καρδιαγγειακή ανατομία, τη λειτουργικότητα, την αιματική ροή και κυρίως το χαρακτηρισμό ιστών [10]. Μερικά από τα μειονεκτήματα της μεθόδου αποτελούν το σχετικά υψηλό κόστος και συχνά η δύσκολη πρόσβαση.
Βιβλιογραφία
1. Rochette L, Guenancia C, Gudjoncik A, Hachet O, Zeller M, Cottin Y, Vergely C. Anthracyclines/trastuzumab: new aspects of cardiotoxicity and molecular mechanisms. Trends Pharmacol Sci. 2015;36(6):326–48.
2. Ishii K, Morii N, Yamashiro H. Pertuzumab in the treatment of HER2-positive breast cancer: an evidence-based review of its safety, efficacy, and place in therapy. Core Evid. 2019;14:51–70.
3. Chen J, Long JB, Hurria A, Owusu C, Steingart RM, Gross CP. Incidence of heart failure or cardiomyopathy after adjuvant trastuzumab therapy for breast cancer. J Am Coll Cardiol. 2012;60(24):2504–12.
4. Swain SM, Baselga J, Kim SB, Ro J, Semiglazov V, Campone M, et al. Pertuzumab, trastuzumab, and docetaxel in HER2-positive metastatic breast cancer. N Engl J Med. 2015;372(8):724–34.
5. Mulrooney DA, Yeazel MW, Kawashima T, Mertens AC, Mitby P, Stovall M, Donaldson SS, Green DM, Sklar CA, Robison LL, Leisenring WM. Cardiac outcomes in a cohort of adult survivors οf childhood and adolescent cancer: retrospective analysis of the childhood cancer survivor study cohort. BMJ. 2009;339:b4606.
6. Curigliano G, Lenihan D, Fradley M, Ganatra S, Barac A, Blaes A, Herrmann J, Porter C, Lyon AR, Lancellotti P, Patel A, DeCara J, Mitchell J, Harrison E, Moslehi J, Witteles R, Calabro MG, Orecchia R, de Azambuja E, Zamorano JL, Krone R, Iakobishvili Z, Carver J, Armenian S, Ky B, Cardinale D, Cipolla CM,
Dent S, Jordan K; ESMO Guidelines Committee. Management of cardiac disease in cancer patients throughout oncological treatment: ESMO consensus recommendations. Ann Oncol. 2020 Feb;31(2):171-190.
7. Čelutkienė J, Pudil R, López-Fernández T, Grapsa J, Nihoyannopoulos P, Bergler-Klein J, Cohen-Solal A, Farmakis D, Tocchetti CG, von Haehling S, Barberis V, Flachskampf FA, Čeponienė I, Haegler-Laube E, Suter T, Lapinskas T, Prasad S, de Boer RA, Wechalekar K, Anker MS, Iakobishvili Z, Bucciarelli-Ducci C, Schulz-Menger J, Cosyns B, Gaemperli O, Belenkov Y, Hulot JS, Galderisi M, Lancellotti P, Bax J, Marwick TH, Chioncel O, Jaarsma T, Mullens W, Piepoli M, Thum T, Heymans S, Mueller C, Moura B, Ruschitzka F, Zamorano JL, Rosano G, Coats AJS, Asteggiano R, Seferovic P, Edvardsen T, Lyon AR. Role of cardiovascular imaging in cancer patients receiving cardiotoxic therapies: a position statement on behalf of the Heart Failure Association (HFA), the European Association of Cardiovascular Imaging (EACVI) and the Cardio-Oncology Council of the European Society of Cardiology (ESC). Eur J Heart Fail. 2020 Sep;22(9):1504-1524.
8. Harries Iwan et al. Magnetic Resonance Imaging to Detect Cardiovascular Effects of Cancer Therapy. J Am Coll Cardiol CardioOnc. 2020;2(2):270–92.
9. Nazanin Fallah-Rad et al. Delayed contrast enhancement cardiac magnetic resonance imaging in trastuzumab induced cardiomyopathy. J Magn Reson Imaging 2008.
10. Bellenger NG, Burgess MI, Ray SG, et al. Comparison of left ventricular ejection fraction and volumes in heart failure by echocardiography, radionuclide ventriculography and cardiovascular magnetic resonance; are they interchangeable? Eur Heart J 2000;21:1387–96.
